生技新药

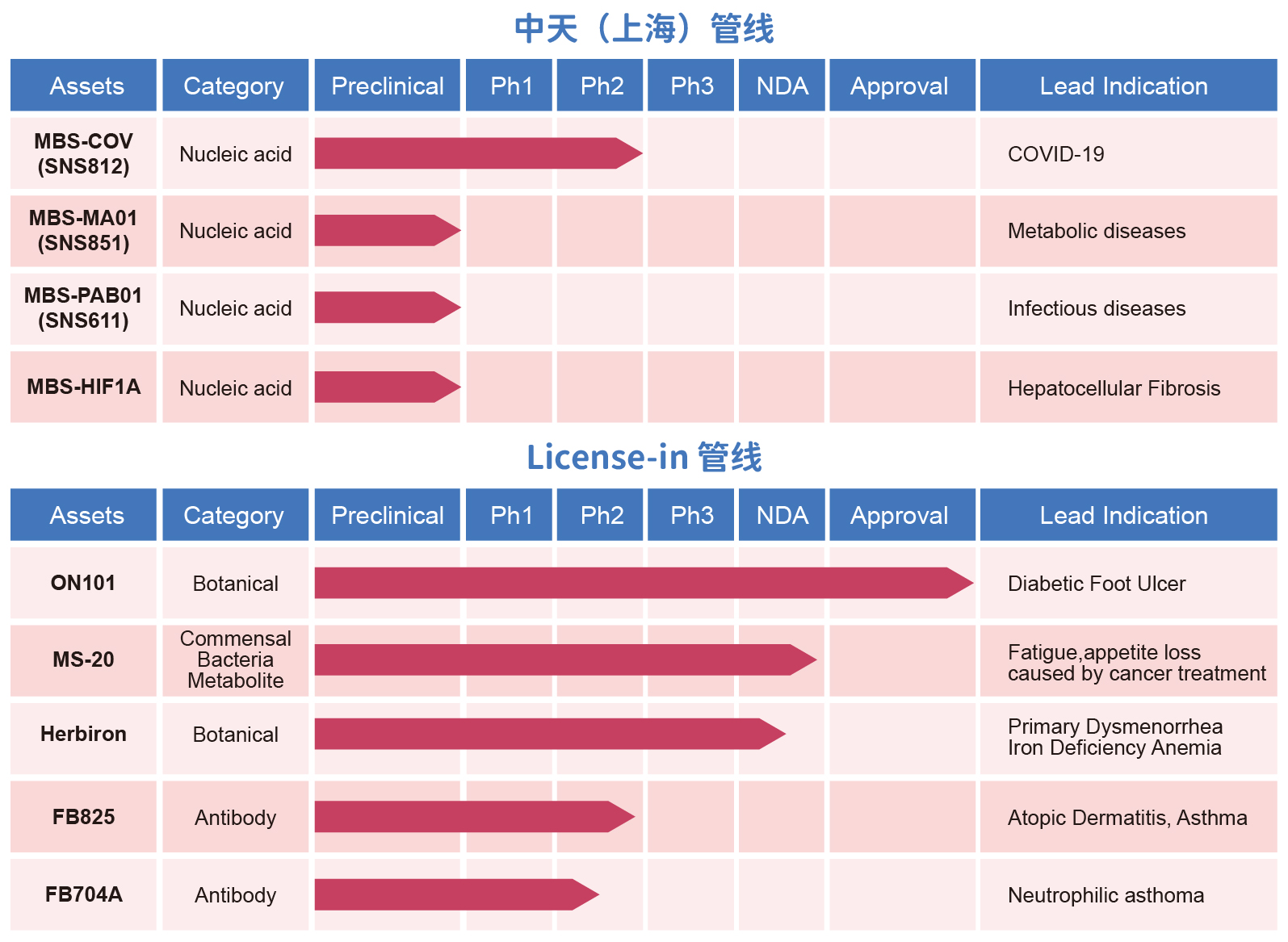
MBS-COV(SNS812)
适应症
冠状病毒病
现况
1. 已完成临床前药理及毒理试验。
2. 已完成一期临床试验,并取得最终临床研究报告(Clinical study report, CSR)。
3. 已完成二期临床试验,并取得最终临床研究报告(Clinical study report, CSR)。
产品优势
1. 目前市场上的药物与疫苗,多数具有副作用且容易被病毒逃脱,进而导致疫情反复爆发。MBS-COV为小核酸药物,靶向病毒不易突变的位置,可广效抑制冠状病毒,相关数据发表于国际医学期刊EMBO Mol Med. 2022;14(4):e15298。
2. 临床试验(NCT05677893、NCT05941793)结果显示MBS-COV具有良好的安全性和广谱疗效:
(1)安全性良好:受试者均无药物相关不良反应。
(2)加速康复:90% 受试者 3 天内转阴。
(3)症状改善:显著改善12种新冠核心症状。
(4)广谱疗效:对高免疫逃脱性病毒株有效。
(5)剂量依赖性:症状缓解、病毒清除均与剂量呈正相关。
藥物机制
MBS-COV为siRNA核酸药物,利用RNA干扰(RNA interference)机制,抑制病毒复制。
市场潜力
根据市场分析机构的统计,到2025年,新冠预防市场将达到607亿美元 (Reportlinker, OCT 2022); 到2031年,治疗市场将达到162亿美元 (Transparency market research, FEB 2023)
MBS-MA01(SNS851)
适应症
减重、代谢疾病
作用机制
调控能量天平,增加基础代谢速率
现况
1.完成研发阶段细胞药理与动物药理、毒理试验, 包括肝细胞株药理实验、人原代肝细胞药理实验、脱靶基因分析与验证、小鼠药效实验、多物种(小鼠与猴子)的毒理试验。数据显示,SNS851为有效、安全的候选药物。
2.正加速推动前临床CMO与CRO实验。
2.正加速推动前临床CMO与CRO实验。
产品优势
小鼠药效数据显示, 在高脂饮食下小鼠呈现:
1.提高基础代谢能力
2.体重不会增胖,降低脂肪堆积
3.脂肪肝程度改善
4.代谢指标:血脂(胆固醇、HDL、LDL)、空腹血糖、胰岛素阻抗获得显著改善
5.肌肉量不会减少各项指标优化而显示小鼠更健康。
1.提高基础代谢能力
2.体重不会增胖,降低脂肪堆积
3.脂肪肝程度改善
4.代谢指标:血脂(胆固醇、HDL、LDL)、空腹血糖、胰岛素阻抗获得显著改善
5.肌肉量不会减少各项指标优化而显示小鼠更健康。
市场潜力
全球减重药物的发展聚焦在防止肌肉流失的减重药物。根据市场分析机构的统计,减肥与脂肪肝全球患者人数分别为30亿与20亿,全球市场预估分别有1000亿(2030年)与325亿 (2032年)美金。
MBS-HIF1A
适应症
癌症
产品优势
1.靶点清楚,机制明确
2.药效可长达3-6个月
3.HIF-1 alpha目前为无药靶点
4.核酸药物合成快速,开发成本低于抗体药
5.易修饰并与其他药物结合使用
2.药效可长达3-6个月
3.HIF-1 alpha目前为无药靶点
4.核酸药物合成快速,开发成本低于抗体药
5.易修饰并与其他药物结合使用
现况
前临床阶段
机制
肿瘤由于生长快速,其内部环境容易形成缺氧,缺氧促使HIF-1 alpha蛋白活化。目前已知HIF-1 alpha的下游路径与肿瘤生长、恶化、转移与抗药性息息相关,但HIF-1 alpha是传统药物所难以触及的靶点,至今却无任何药物成功上市。MBS-HIF1A为核酸药物,利用其特有机制和专利靶向递送技术,专一性抑制HIF-1 alpha基因表现,进而达到治疗肿瘤的目的。
市场潜力
目前已知所有肿瘤中,缺氧最严重的肿瘤分别为肝癌、胰脏癌与前列腺癌,且都是缺乏有效药物的未满足医疗缺口(Unmet medical need),潜在市场高达数十亿美金,这三种癌症均可作为MBS-HIF1A优先靶向的潜在适应症。
ON101
适应症
糖尿病足溃疡。
现况
1.完成国际多中心三期临床试验(MRCT),ON101达显著疗效(16周完全愈合率为60.7% vs. 35.1%, p=0.0001)。不同困难伤口完全愈合之次族群分析,亦显现ON101的疗效显著性。相关数据发表于国际医学期刊JAMA Network Open(JAMA Network Open. 2021;4(9):e2122607)。
2.中国大陆、台湾、澳门、新加坡、马来西亚新药药证核准;菲律宾、越南及印度尼西亚受理药证审查。
3.美国FDA快速审查认定,美国三期临床试验进行中。
4. 大陆市场的独家代理授权华润双鹤药业,合约期间20年,迄2043年止。
2.中国大陆、台湾、澳门、新加坡、马来西亚新药药证核准;菲律宾、越南及印度尼西亚受理药证审查。
3.美国FDA快速审查认定,美国三期临床试验进行中。
4. 大陆市场的独家代理授权华润双鹤药业,合约期间20年,迄2043年止。
产品优势
1.有效性:临床试验证实ON101对于伤口愈合具有显著之疗效并可减少疤痕的形成。
药物机制
1.抑制发炎作用
2.调节胶原蛋白生成
3.促进损伤细胞的再生能力
4.促进人类角质细胞增生
2.调节胶原蛋白生成
3.促进损伤细胞的再生能力
4.促进人类角质细胞增生
市场潜力
依据Fortune Business Insights的市场调查报告,糖尿病足溃疡(DFU)的全球市场规模在2018年为66亿美元,年复合成长率为6.8%,2026年市场预估约为110亿美元。
- ON101的植物萃取物、用途与制程技术,已进行完整之全球专利布局,并取得美国(发明专利,专利号US7985431B2、US8247004B2、US8449924B2、US9872879B2、US8105636B2、US10376488B2)、欧盟(发明专利,专利号1925310、2030626、2596798)、马来西亚(发明专利,专利号MY-160153-A)、印度(发明专利,专利号263530)、日本(发明专利,专利号5086111、6290531)、中国(发明专利,专利号ZL 2007 1 0188280.3、ZL 2012 1 0128422.8)、韩国(发明专利,专利号10-0983754、10-1759751)与俄罗斯(发明专利,专利号2440819)专利,有效保护其智慧财产与技术。
- 糖尿病足部伤口溃疡新药“香雷糖足膏®”乳膏(ON101),国际三期临床试验结果显著优于标准治疗,经16周治疗,伤口完全愈合率超过60%, 与目前美国FDA核准之药物Regranex相比,临床数据更佳,可望在未来的糖尿病伤口愈合治疗市场上创造价值,嘉惠众多的糖尿病足溃疡患者。
化疗漾MS20
适应症
改善癌症病患因化学治疗所引起的疲劳及食欲不振
成分
MS-20是大豆发酵代谢物的混合物,以微生物模拟人体肠道环境经严格控制的发酵过程反應所产生。
服用剂量與方式
每次服用4毫升,每日两次分别以温开水100毫升稀释后空腹食用。
现况
已于台湾地区上市
产品优势
1.具改善肠道微生态功能。
2.提升免疫,改善患者化疗时之不良反应。
藥物机制
公司实验数据显示,MS20能改善受试者的肠道菌丛,增加菌种多样性及丰富度,同时提升多种免疫细胞活性。此外,小鼠实验数据还显示,口服MS20可以提升罹癌小鼠对免疫检查点药物(anti-PD1)的反应率,罹癌小鼠的存活率提升超过2倍。
市场潜力
MS-20未来有机会合并应用于免疫检查点药物市场。根据知名分析机构Market Data Forecast的预测,2019年免疫检查点药物市场已达129亿美金,未来年复合成长高达28.68%,2024年的市场价值将到达454亿美金。 (https://www.marketdataforecast.com/market-reports/global-checkpoint-inhibitors-market)
FB825
适应症
异位性皮肤炎、过敏性气喘、高IgE症候群、食物过敏等过敏疾病。
产品优势
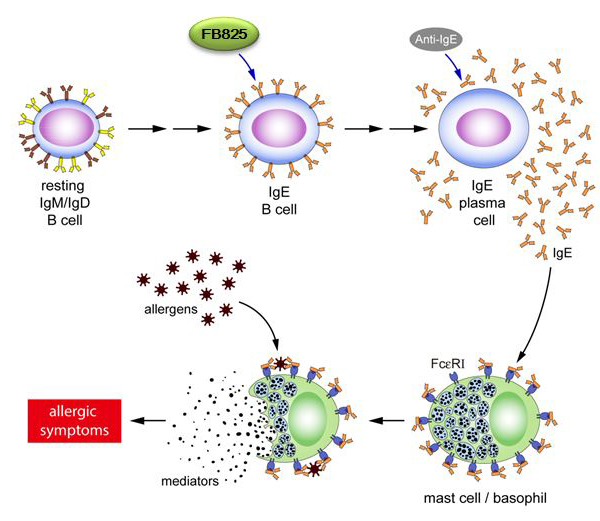
1.特殊性:新颖作用标的与作用机制,抑制IgE的生产源头IgE B细胞。
2.安全性:药理机制明确,副作用低。
3.广泛性:适应症宽广,且可适用于更多的过敏和气喘患者。
4.经济性:FB825具有优异药物动力学特性,能长时间在人体产生作用,预期能够2~3个月用药一次,长效作用的优势将大幅提高病患方便性以及医疗成本。
2.安全性:药理机制明确,副作用低。
3.广泛性:适应症宽广,且可适用于更多的过敏和气喘患者。
4.经济性:FB825具有优异药物动力学特性,能长时间在人体产生作用,预期能够2~3个月用药一次,长效作用的优势将大幅提高病患方便性以及医疗成本。
现况
1.二期临床试验進行中。
2.全球范围内研发与商品化的独家权利授权给Leo Pharma。
2.全球范围内研发与商品化的独家权利授权给Leo Pharma。
机制
FB825为拟人化的新一代IgG1单株抗体新药,可与人体B细胞表面上IgE的CεmX片段结合,进而引起细胞毒杀反应,于前期直接封鎖會分泌IgE 的B淋巴细胞,进而阻断後續浆细胞(Plasma cell)的及IgE 的大量生成,达成治疗与预防过敏疾病的效果。
市场潜力
根据Allied Market Research与Coherent Market Insights分析报告,异位性皮肤炎/哮喘治疗全球市场将于2027年达380亿美元。
- FB825已获得美国(发明专利,专利号US8460664B2、US8741294B2、US8974794B2)、欧盟(发明专利,专利号EP2401300B1)、日本(发明专利,专利号JP5848133B2、6068582)、中国(发明专利,专利号ZL201080009485.0、ZL201510069440.7)等主要制药国专利核准,建立完整药物、功效及抗原决定位之全球专利保护。
- FB825已完成美国一期临床实验,确认在人体上使用的安全性,並已在少樣本的探索性试验中,證明藥物疗效。目前美国人体二期试验正加速进行,此外,FB825也获得美国FDA用于治疗「高免疫球蛋白E症候群」(Hyper IgE Syndrome)的孤儿药认定。